研究内容

機能病態分子学教室は,2006年4月に分子生体膜研究所が東北薬科大学に創設された際発足しました。「機能病態分子学」のその名が示すように,細胞膜の情報伝達の要であるマイクロドメインに存在するスフィンゴ糖脂質(糖脂質)の生合成制御機構の解明と,以下に述べる病態生理学的意義についての研究を進めています。
(1)生活習慣病
2型糖尿病などの代謝異常における基礎病態であるインスリン抵抗性の発症において,脂肪組織より分泌されるTNFαによって酸性の糖脂質であるガングリオシドGM3の発現増加が,インスリン抵抗性を誘導することを世界に先駆けて見いだしました。私たちが開発した糖脂質生合成阻害剤の誘導体は,新たな生活習慣病の治療法として有効であることが示されつつあり,“マイクロドメイン矯正療法”の開発を目指し研究を進めています。
メタボリックシンドロームに伴う慢性炎症の新たな制御因子を発見
【概要】
東北医科薬科大学 分子生体膜研究所の井ノ口仁一特任教授と狩野裕考助教らの研究グループは、ミラノ大学、東京大学、大阪大学、岐阜大学との共同研究で、肥満やメタボリックシンドロームに伴う慢性炎症の新たな制御因子(ガングリオシドGM3)を発見し、慢性炎症が原因で発症する様々な疾患に関する次世代の診断と治療の可能性を見出しました。
この発見は、欧州分子生物学機構の科学雑誌「The EMBO Journal」の5月7日午後7時(日本時間)のオンライン版に掲載されました。
本研究は、日本学術振興会科学研究費助成事業基盤研究(B)、挑戦的研究(萌芽)、若手研究(B)、研究活動スタート支援および武田科学振興財団特定研究助成、医用薬物研究奨励富岳基金、水谷糖質科学財団の助成を受けて行われました。
【研究内容】
自然免疫*1受容体Toll-like receptor 4 (TLR4) *2を介した慢性炎症*3は、メタボリックシンドロームの発症を決定づける強力な増悪因子です。どのような手法で慢性炎症を予測・予防し、恒常性維持状態へと回復・正常化できるのか、その作用点となる分子メカニズムの解明と新たな診断法・治療法の開発が大きく期待されています。脂肪組織や血清中に存在するスフィンゴ糖脂質*4であるガングリオシドGM3*5には、異なるセラミド構造を持つ多様な分子種が存在しています(図1 A)。これらのGM3分子種の血清中の発現パターンは、メタボリックシンドロームの発症過程で変動しています (図1B)。これらのGM3分子種の生理活性を検討したところ、極長鎖飽和・水酸化GM3分子種(C22:0,C24:0, hC24:0)は、LPS*6刺激によるTLR4の活性化によるマクロファージからのTNFαやIL6などの炎症性サイトカインの産生を著しく促進し(図1C)、炎症反応を増大させました。一方、長鎖GM3分子種(16:0, 18:0, 20:0)および不飽和GM3分子種(24:1, h24:1)は、炎症反応を抑制しました (図1C)。さらに、長鎖・不飽和GM3分子種は炎症促進性GM3の作用をキャンセルしました。これらのことから、肥満やメタボリックシンドローム発症初期においては、GM3分子種の炎症促進性シフトに伴って慢性炎症が生じていると考えられます(図1B, D)。計算シミュレーションの結果からは、GM3がTLR4に直接結合している可能性が得られました。自然免疫に重要な役割を持っているTLR4を介した慢性炎症は、多様な炎症性疾患やがんの発症にも深く関与しており、全身を循環する血清GM3分子種の発現変動パターンと、さまざまな疾患との関連性が明らかになれば、慢性炎症性疾患の新規診断・治療法の開発につながっていくものと期待されます(図2)。
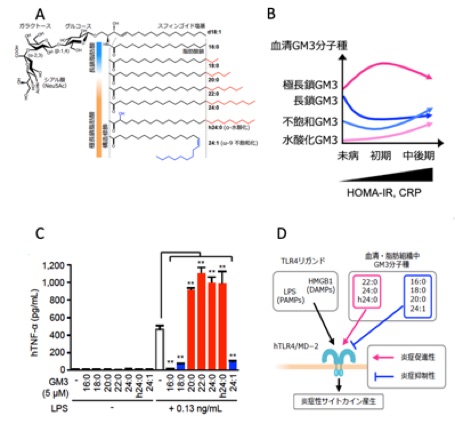
図1 GM3分子種の自然免疫および肥満などの慢性炎症性疾患への関与
ガングリオシドGM3の分子種多様性。 (B) GM3分子種のメタボリックシンドローム発症過程における発現変化。(C) 極長鎖GM3分子種によるTLR4の活性化促進と長鎖GM3分子種による抑制。 (D) GM3分子種によるTLR4活性化および抑制作用の構造活性相関。
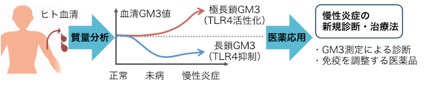
図2 GM3分子種にもとづく次世代の診断・治療法開発への発展性
血清中のガングリオシドGM3の生理活性が判明したことにより、様々な医薬応用が期待できる。血清GM3の測定による病気の診断や、GM3を応用した免疫抑制・活性化医薬品の開発などが挙げられる。
【論文名】
Homeostatic and pathogenic roles of GM3 ganglioside molecular species in TLR4 signaling in obesity.
掲載誌: EMBO J https://www.embopress.org/doi/10.15252/embj.2019101732
【著者名】
Kanoh, H., Nitta, T., Go, S., Inamori, K., Veillon, L., Nihei, W., Fujii, M., Kabayama, K., Shimoyama, A., Fukase, K., Ohto, U., Shimizu, T., Watanabe, T., Shindo, H., Aoki, S., Sato, K., Nagasaki, M., Yatomi, Y., Komura, N., Ando, H., Ishida, H., Kiso, M., Natori, Y., Yoshimura, Y., Cattaneo, A., Letizia, M., Zonca, A., Ciampa, M., Mauri, M., Prinetti, A., Sonnino, S., Suzuki, A. and Inokuchi, J. (2020)
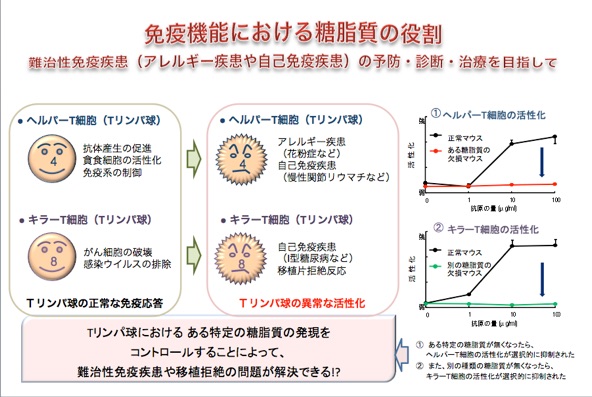
(2) Sphingoimmunology
私たちは、スフィンゴ糖脂質の獲得免疫と自然免疫における役割を解明しつつあり、この研究を Sphingoimmunologyと名付けました。
現在使用されている免疫抑制剤は全てのT細胞の機能を抑制することから,様々な副作用が問題になっています。ヘルパーT細胞とキラーT細胞の機能は,異なるガングリオシド分子種によって機能が選択的に制御されていることが明らかになってきました。この発見を新しい免疫機能の制御法開発に繋げるべく研究を進めています。
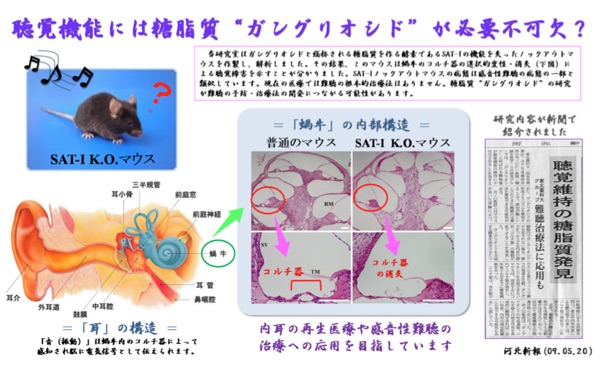
(3)聴覚機能
GM3はガングリオシド分子群生合成の最初の物質ですが,私たちは研究の中でGM3合成酵素ノックアウトマウスは内耳コルチ器の崩壊による聴覚異常を示すことを見いだしました。コルチ器は音の振動を神経信号に変換する器官で,多くの難聴患者で変性が認められます。コルチ器はいったん損傷を受けた場合再生は不可能であり,難聴の根本的治療法は確立されていません。私たちは糖脂質の聴覚機能役割を研究し,新たな難聴治療法の開発に挑戦しています。
※参考記事
糖脂質「ガングリオシド」が聴覚機能に必要不可欠であることを発見
(科学技術振興機構(JST)プレスリリース記事 2009年5月19日)
http://www.jst.go.jp/pr/announce/20090519/index.html
インスリン抵抗性の新たなメカニズム解明に成功
(科学技術振興機構(JST)プレスリリース記事 2007年8月14日)
http://www.jst.go.jp/pr/announce/20070814/index.html
)