新 着 情 報
| 2023/4/07 | 【更新】HP を更新しました。 |
|---|
| 2023/7/28 | 【更新】「Publication」 を更新しました。 |
|---|

天然物化学教室では、陸棲・海洋微生物 (放線菌、糸状菌、ラン藻など) や海洋無脊椎動物 (海綿、ホヤ、軟体サンゴなど)、植物を中心とした自然界に存在する生き物 (天然資源) から「薬の種子 (シード)」 を見つけることを目的とした、新規生物活性物質 (天然物) の探索研究を展開しています。天然物は、その構造の多様性と興味深い生物活性から、上市されている低分子医薬品の実に 6 割が何らかのかたちで役立っています。
我々は、まずフイールドワークで天然資源を集めることから始め、その培養液や抽出液をライブラリ化します。次に、これらの中から生物検定試験 (バイオアッセイ) の結果を指標に活性物質の単離精製を行い、最終的に立体を含めた天然物の化学構造と生物活性を明らかにします。現在は、感染症治療薬、抗がん剤や生活習慣病治療薬のスクリーニングを中心に進めています。また、採取の過程で得られる稀な微生物・海洋生物については、LCMS を利用した代謝産物の網羅的な解析・取得を行い、オリジナルの天然物ライブラリの構築にも努めています。
さらに天然物の新たな可能性を引出すために、特殊培養条件の検討、生合成経路の解析、構造活性相関研究やケミカルバイオロジー的なアプローチによる活性発現機構の解明などの応用研究も行っています。

アウトライン

天然資源のサンプリング
微生物、海洋生物や植物などの天然素材を求めて、フィールドワークへ

微生物・海洋生物・植物ライブラリ
集めた天然素材をライブラリー化し、生物活性物質のスクリーニングに利用

生物活性物質のスクリーニング
天然資源ライブラリの中から、感染症やがん、生活習慣病などの薬の種 (シード) となる可能性のあるものを調査

生物活性物質の単離精製
スクリーニングで選択されたサンプルから、目的とする化合物を単離精製

生物活性物質の構造解析

天然有機化合物ライブラリ
スクリーニング系の紹介

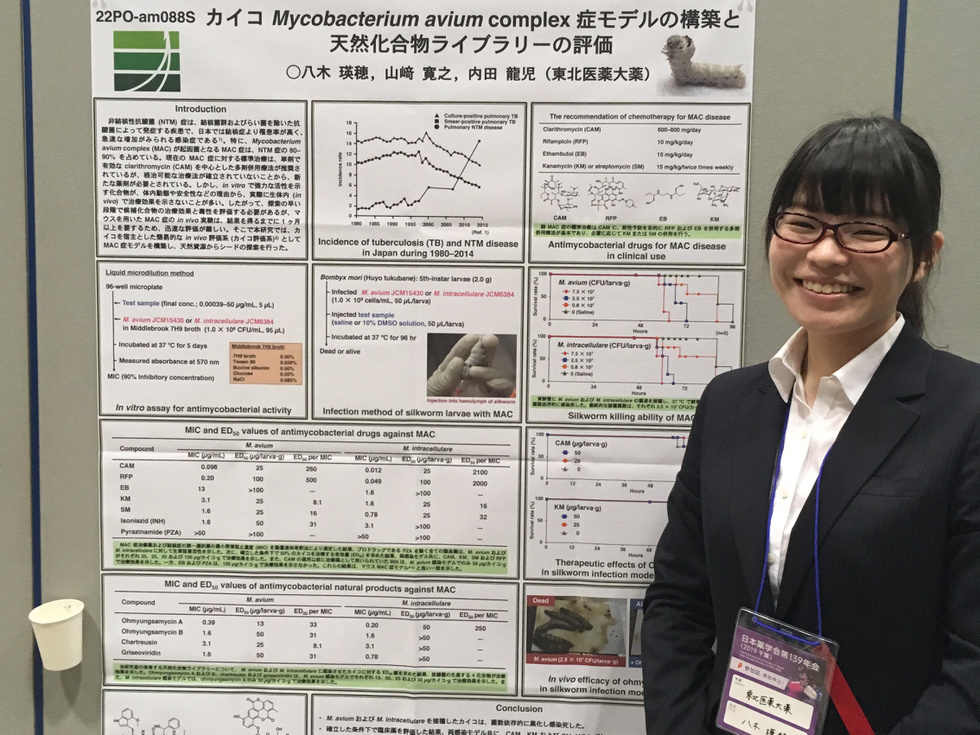
カイコ感染症モデル
カイコを感染症モデルとして利用した簡易的な in vivo スクリーニング

PTP1B 阻害薬
糖尿病治療薬、抗がん薬への応用
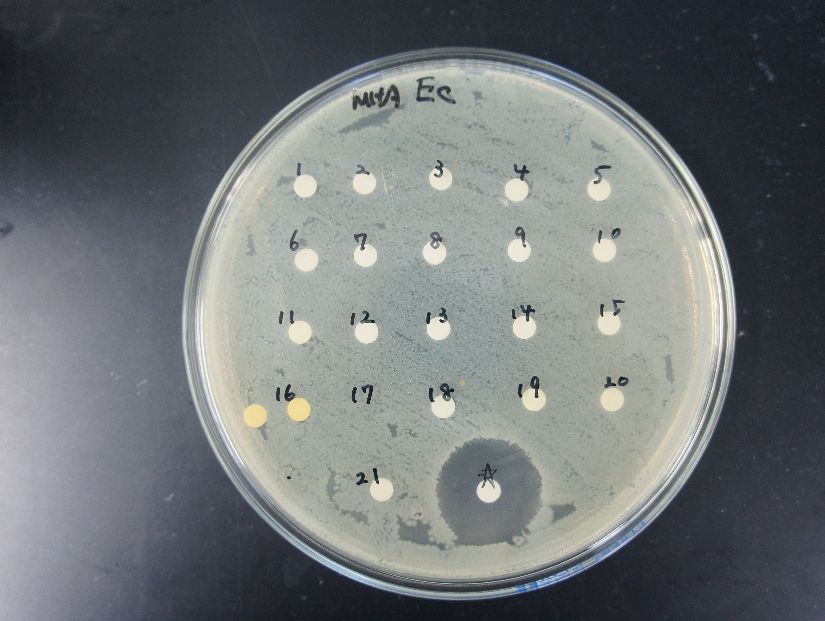
抗菌・抗真菌薬
様々な感染症治療薬への応用
その他
ケミカルエピジェネティクスに基づいた新規生物活性物質の創出

高濃度ハロゲン化物塩耐性変異糸状菌を用いた物質生産能の拡大

特殊培養条件による新規物質の取得

LCMS を利用した希少微生物・海洋生物の代謝産物の網羅的解析

D2 Sarah H. Rotinsulu
M1 朝霧 育美
M1 大嶋 菜月
B6 伊藤 雅茂
吉田 萌衣
戸村 仁美
今野 亜美
今野 玲成
根本 沙季
菊地 貴大
山本 晴大
若松 千乃
嶋田 知紘
二宮 尚樹
齋藤 悠
B5 白石 京子
浅野 和希
神田 桃伽
高橋 龍
奥山 愛佳
佐藤 優月
森本美空
車田 鈴菜
冨樫 慶一郎
斉藤 玲
中島 奏海
B4 黒沢 亮


天然資源からの創薬研究に興味がある学生さんはもちろん、実験が大好きな学生さんは大歓迎です。一緒に薬のタネを探してみませんか?
進学、研究内容などに関する問い合わせは、随時受け付けます。
中学生・高校生の皆さんも、気軽にどうぞ。
大学院進学に関する情報はこちらから
東北医科薬科大学
薬学部
天然物化学教室
〠981-8558 宮城県仙台市青葉区小松島 4-4-1
e-mail: natprodchem[at]tohoku-mpu.ac.jp *[at] を@ にして下さい。
または、スタッフの公式アドレスまでお願いします。
4-4-1 Komatushima, Aoba-ku, Sendai, Miyagi 981-8558, Japan
Laboratry of Natural Product Chemistry
Faculty of Pharmaceutical Sciences
Tohoku Medical & Pharmaceutical University